细胞转染介绍
1 .实验目的
学习和掌握 外源基因导入真核细胞的主要方法 — 脂质体介导的转染。了解外源基因进入的一般性方法,观测外源蛋白的表达(绿色荧光蛋白),为染色准备实验材料。
2 .实验原理
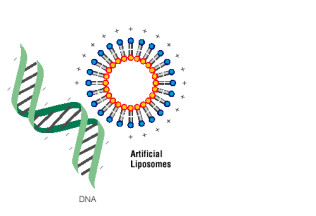
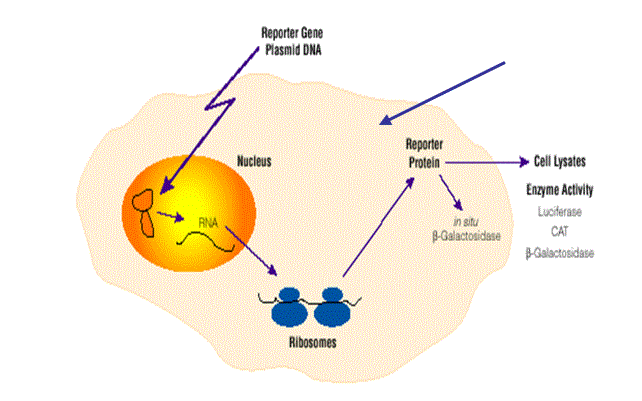
上图 所示是脂质体介导转染的示意图,它显示了外源质粒进入细胞的一般过程。
外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体 介导法和病毒介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;病毒法是利用包装了外源基因的病毒感染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;病毒法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法。
利用脂质体转染法最重要的就是防止其毒性,因此脂质体与质粒的比例,细胞密度以及转染的时间长短和培养基中血清的含量都是影响转染效率的重要问题,通过实验摸索的合适转染条件对于效率的提高有巨大的作用。
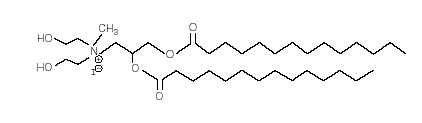
上图是本次实验采用的脂质体中阳离子组分的结构的示意图。本次实验采用的脂质体是 promega 公司的 TransFast 脂质体试剂,它是一种阳离子脂质体和中性脂质体的混合物,是对于本次实验中采用的 293T 细胞优化的转染试剂。
3. 实验步骤
细胞传代
(1) 试验准备: 200ul/ 1ml Tip 头 各 一盒(以上物品均需高压灭菌) , 酒精棉球,废液缸,试管架, 微量移液器, 记号笔 , 培养 皿 , 离心管 。
(2 ) 弃掉培养皿 中的培养基,用 1 ml 的 PBS 溶液洗涤两次。
( 3 ) 用 Tip 头加入 1ml Trypsin 液,消化 1 分钟( 37 。 C , 5%CO 2 ) 。用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。
( 4 ) 加入 1ml 的含血清培养基终止反应。
( 5 ) 用 Tip 头多次吹吸,使细胞完全分散开。
( 6 ) 将培养液装入离心管中, 1000rpm 离心 5min 。
(7) 用培养液重悬细胞,细胞计数后选择 0.8X10 6 个细胞加入一个 35mm 培养皿。
(8) 将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。
( 9 ) 将培养皿 转入 CO 2 培养箱中培养 ,第二天转染 。
细胞转染
1 )转染试剂的准备
A. 将 4 00ul 去核酸酶水加入管中,震荡 10 秒 钟,溶解脂状物。
B . 震荡后将试剂放在 -20 摄氏度保存,使用前还需震荡 , 。
2 ) 选择合适的混合比例 ( 1 : 1 - 1 : 2/ 脂质体体积: DNA 质量) 来转染细胞。在一个转染管中加入合适体积的无血清培养基。加入合适 质量 的 MyoD 或者 EGFP 的 DNA ,震荡后在加入合适体积的转染试剂, 再次震荡。
5 ) 将混合液在室温放置 10—15 分钟。
6) 吸去培养板中的培养基,用 PBS 或者无血清培养基清洗一次。
7 ) 加入混合液,将细胞放回培养箱中培养一个小时。
8 ) 到时后,根据细胞种类决定是否移除混合液,之后加入完全培养基 继续培养 24 - 48 小时 。
第二次细胞传代
1) 在转染后 24 小时,观察实验结果并记录绿色荧光蛋白表达情况。
2) 再次进行细胞传代,按照免疫染色合适的密度 0.8X10 5 个细胞 /35mm 培养皿将细胞重新粉入培养皿中。
3) 在正常条件下培养 24 小时后按照染色要求条件固定。
学习和掌握 外源基因导入真核细胞的主要方法 — 脂质体介导的转染。了解外源基因进入的一般性方法,观测外源蛋白的表达(绿色荧光蛋白),为染色准备实验材料。
2 .实验原理


上图 所示是脂质体介导转染的示意图,它显示了外源质粒进入细胞的一般过程。
外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体 介导法和病毒介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;病毒法是利用包装了外源基因的病毒感染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;病毒法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法。
利用脂质体转染法最重要的就是防止其毒性,因此脂质体与质粒的比例,细胞密度以及转染的时间长短和培养基中血清的含量都是影响转染效率的重要问题,通过实验摸索的合适转染条件对于效率的提高有巨大的作用。

上图是本次实验采用的脂质体中阳离子组分的结构的示意图。本次实验采用的脂质体是 promega 公司的 TransFast 脂质体试剂,它是一种阳离子脂质体和中性脂质体的混合物,是对于本次实验中采用的 293T 细胞优化的转染试剂。
3. 实验步骤
细胞传代
(1) 试验准备: 200ul/ 1ml Tip 头 各 一盒(以上物品均需高压灭菌) , 酒精棉球,废液缸,试管架, 微量移液器, 记号笔 , 培养 皿 , 离心管 。
(2 ) 弃掉培养皿 中的培养基,用 1 ml 的 PBS 溶液洗涤两次。
( 3 ) 用 Tip 头加入 1ml Trypsin 液,消化 1 分钟( 37 。 C , 5%CO 2 ) 。用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。
( 4 ) 加入 1ml 的含血清培养基终止反应。
( 5 ) 用 Tip 头多次吹吸,使细胞完全分散开。
( 6 ) 将培养液装入离心管中, 1000rpm 离心 5min 。
(7) 用培养液重悬细胞,细胞计数后选择 0.8X10 6 个细胞加入一个 35mm 培养皿。
(8) 将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。
( 9 ) 将培养皿 转入 CO 2 培养箱中培养 ,第二天转染 。
细胞转染
1 )转染试剂的准备
A. 将 4 00ul 去核酸酶水加入管中,震荡 10 秒 钟,溶解脂状物。
B . 震荡后将试剂放在 -20 摄氏度保存,使用前还需震荡 , 。
2 ) 选择合适的混合比例 ( 1 : 1 - 1 : 2/ 脂质体体积: DNA 质量) 来转染细胞。在一个转染管中加入合适体积的无血清培养基。加入合适 质量 的 MyoD 或者 EGFP 的 DNA ,震荡后在加入合适体积的转染试剂, 再次震荡。
5 ) 将混合液在室温放置 10—15 分钟。
6) 吸去培养板中的培养基,用 PBS 或者无血清培养基清洗一次。
7 ) 加入混合液,将细胞放回培养箱中培养一个小时。
8 ) 到时后,根据细胞种类决定是否移除混合液,之后加入完全培养基 继续培养 24 - 48 小时 。
第二次细胞传代
1) 在转染后 24 小时,观察实验结果并记录绿色荧光蛋白表达情况。
2) 再次进行细胞传代,按照免疫染色合适的密度 0.8X10 5 个细胞 /35mm 培养皿将细胞重新粉入培养皿中。
3) 在正常条件下培养 24 小时后按照染色要求条件固定。