慢病毒构建及注意事项
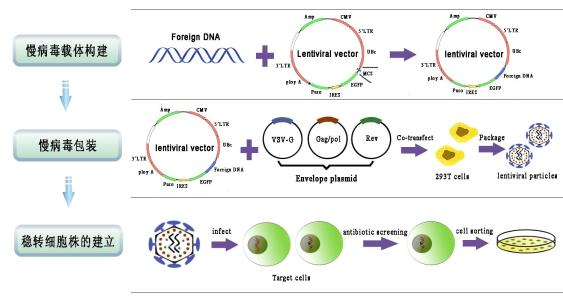
实验流程:
1、根据目的基因相关信息(序列,序列号等),构建含有外源基因或siRNA
的重组载体;
2、对于测序正确的重组质粒,提取和纯化高质量的不含内毒素的重组质粒;
3、使用高效重组载体和病毒包装质粒共转染293T细胞,进行病毒包装和生产,收集病毒液;
4、浓缩、纯化病毒液;
5、用高质量的病毒液感染细胞;
6、通过定量PCR精确测定病毒滴度(高精确滴定方法)和Western分析实验结果;
7、用高质量的病毒液感染宿主细胞;检测基因功能或者siRNA的沉默效率以及使用药物进行稳定转染细胞株的筛选,通常状况下,筛选的细胞克隆株具有长期的表达性,病毒液足够用于一般的动物活体实验。
1、慢病毒使用操作:
1.1慢病毒的储存与稀释:
1.1.1病毒的储存:用户收到病毒液后在很短时间内即使用慢病毒进行实验,可以将病毒暂时放置于4 ℃保存;如需长期保存请放置于-80℃ (病毒置于冻存管,并使用封口膜封口);
A.病毒可以存放于-80 ℃ 6个月以上;但如果病毒储存时间超过6个月,建议在使用前需要重新滴定病毒滴度
B.反复冻融会降低病毒滴度:每次冻融会降低病毒滴度10%;因此在病毒使用过程中应仅尽量避免反复冻融,为避免反复冻融我们强烈建议客户收到病毒后按照每次的使用量进行分装。
1.1.2病毒的稀释:用户需要稀释病毒时,请将病毒取出置于冰浴融解后,使用培养目的细胞用PBS或无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后4 ℃
保存(请尽量在三天内用完)分装后使用。
1.2慢病毒用于体外(In Vitro) 实验:感染培养原代细胞和建系细胞
1.2.1慢病毒对各种细胞和组织的亲嗜性不同,用户使用Invabio 提供的慢病毒之前可以通过查阅相关文献,了解慢病毒对您的目的细胞的亲嗜性,感染复数(MOI值)以及在体(In Vivo)注射所需要的病毒量。如果没有相关文献支持,可以通过感染预实验得到合适的感染复数(MOI)值(使用24孔板检测病毒对目的细胞的亲嗜性)
1.2.2慢病毒感染目的细胞预实验
1.2.2.1慢病毒感染目的细胞预实验注意事项
A.测定慢病毒对目的细胞的亲嗜性时,需要同时设置对慢病毒亲嗜性较高的细胞(HEK293T,Hela) 作为平行实验的对照细胞。
B.在进行慢病毒感染实验时,可以用完全培养基(培养目的细胞用)稀释;理论上,含有血清,双抗或者其他营养因子的完全培养基不影响慢病毒的感染效率。
C. Invabio提供的病毒单位为TU/ml, 即每毫升中含有具有生物活性的病毒颗粒数。如:病毒滴度为>1X108 TU/ml即每毫升病毒液中至少含有1X108个具有生物活性的慢病毒颗粒。
2、慢病毒使用安全使用规范
Invabio提供的慢病毒为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒。慢病毒中的毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒因此没有毒性作用。但该病毒仍然具有可能的潜在的生物学危险,Invabio建议不要使用编码已知或可能会致癌的基因的假型病毒。除非已经完全公认某个基因肯定没有致癌性,否则均不建议采用假型病毒进行生物学实验。
使用时请参照如下所示进行实验:
2.1. 病毒操作时最好使用生物安全柜。如果使用普通超净工作台操作病毒,不要打开排风机。
2.2. 病毒操作时请穿实验服,带口罩和手套。
2.3. 操作病毒时特别小心不要产生气雾或飞溅。如果操作时超净工作台有病毒污染,请立即用70 % 乙醇加1 % 的SDS溶液擦拭干净。接触过病毒的枪头,离心管,培养板,培养液请于84消毒液或1 % SDS中浸泡过夜后弃去。
2.4. 用显微镜观察细胞感染情况时应遵从以下步骤:拧紧培养瓶或盖紧培养板。用70 %乙醇清理培养瓶外壁后到显微镜处观察拍照。离开显微镜实验台之前,用70 %乙醇清理显微镜实验台。
2.5.如需要离心,应使用密封性好的离心管,或者用封口膜封口后离心,而且尽量使用组织培养室内的离心机。
3、悬浮细胞感染方法概要
1.1 根据细胞的量将细胞在1.5 ml 管中离心收集然后用100-200 ul 的无血清培养液稀释细胞沉淀,以细胞完全浸没在培养基中为准
1.2按照MOI换算病毒颗粒数量,吸取病毒液加入细胞中,将1.5 ml 管放在37 ℃培养箱中孵育30分钟
1.3将管中混合溶液吸出加到培养皿中或孔里
1.4加入足够量的新鲜培养液
1.5 12 小时后换液
1.6 96小时后观察细胞阳性率